
Roztwory buforowe to jedno z bardziej skomplikowanych zagadnień, z jakimi możesz się spotkać na Olimpiadzie Chemicznej Juniorów. Nie od dziś wiadomo jednak, że nawet najtrudniejsze wyzwania stają się łatwiejsze dzięki praktyce. Dlatego spróbujmy zajrzeć do roztworów buforowych od kuchni. Zależy Ci by osiągnąć wysoki wynik w nadchodzącej edycji Olimpiady Chemicznej Juniorów? Jeżeli tak, to nie czekaj dłużej i już dziś zapoznaj się z naszą ofertą kursów!
Aby zobrazować sobie zasadę działania buforów w praktyce, przeprowadźmy eksperyment, w którym mamy:
1. dwa roztwory, każdy z nich po 50 ml, oznaczone A i B;
2. roztwór 0,2 M kwasu solnego (HCl);
3. roztwór 0,2M wodorotlenku sodu (NaOH);
4. miernik pH.
pH roztworu A wynosi 7,0, a więc jest całkowicie neutralne. Gdy dodamy do niego 10 ml 0,2 M HCl, pH spada do 1,5. Natomiast po dodaniu do tego samego wyjściowego roztworu A 10 ml 0,2 M NaOH pH wzrasta do 12,5. W obu przypadkach dostrzegamy więc drastyczną zmianę pH spowodowaną wzrostem lub spadkiem stężenia jonów H+.
Przeprowadźmy identyczne doświadczenie na roztworze B, którego wyjściowe pH również wynosi 7,0. Po dodaniu 10 ml 0,2 M HCl pH spada jedynie o 0,2 jednostki (do 6,8), a po dodaniu 10 mL 0,2 M NaOH pH nieznacznie wzrasta z 7,0 do 7,2.
Z przeprowadzonych eksperymentów wynika, że pH roztworu A ulega drastycznym zmianom pod wpływem silnych kwasów i zasad, natomiast roztwór B nie jest podatny na takie zmiany. zaprezentowane właściwości wynikają z faktu, że roztworem A była w tym eksperymencie woda, a roztworem B – bufor.

Źródło: www.pexels.com
Bufor jest wodnym roztworem, który nie jest podatny na zmiany pH pod wpływem dodania kwasu lub zasady. Ponadto dodanie wody do buforu lub jej odparowywanie nie wpływa znacząco na jego pH. Zasadniczo bufory są roztworem słabego kwasu i sprzężonej z nim zasady (zgodnie z teorią kwasów i zasad Brønsteda) lub roztworem słabej zasady i sprzężonego z nią kwasu.
Najpopularniejsze bufory wykorzystywane w laboratoriach można przygotować zasadniczo na dwa proste sposoby:
1. mieszanie roztworu słabego kwasu i sprzężonej z nim zasady – np. CH3COOH i CH3COO–;
2. mieszanie roztworu słabej zasady i sprzężonej z nią kwasu – np. NH3 i NH4+.
Przykładowo bufor fosforanowy należy do drugiej z powyższych kategorii. Składa się ze słabej zasady HPO42- i sprzężonego z nią kwasu H2PO4–, a pH przygotowanego roztworu wynosi 7,4.
1. Po dodaniu mocnej zasady obecny w roztworze kwas neutralizuje jony OH–.
2. Po dodaniu mocnego kwasu zasada z buforu neutralizuje jony H+.
W lepszym zrozumieniu tej zasady pomogą poniższe przykłady.
Załóżmy, że dysponujemy buforem octanowym, zawierającym kwas CH3COOH i sprzężona zasadę CH3COO–.
Po dodaniu mocnego kwasu jony H+ (w formie H3O+) reagują z zasadą, dając w efekcie kwas octowy (który również jest składnikiem buforu).
CH3COO– + H3O+ ⇆ CH3COOH + H2O
Z drugiej strony dodanie mocnej zasady skutkuje przereagowaniem kwasu octowego i powstaniem jonów octanowych.
CH3COOH + OH– ⇆ CH3COO– + H2O
Rozpatrzmy bufor drugiej klasy, który zawiera zasadę NH3 i kwas NH4+.
Po dodaniu mocnego kwasu amoniak neutralizuje jony H+ (w formie H3O+), tworząc jony amonowe NH4+.
NH3 + H3O+ ⇆ NH4+ + H2O
W przypadku dodania zasady reakcji ulega kwas NH4+.
NH4+ + OH– ⇆ NH3 + H2O

Źródło: www.pexels.com
Załóżmy, że nasz modelowy bufor składa się ze słabego kwasu (HA) i sprzężonej z nim zasady (A–). W takim przypadku równowaga kwasowo-zasadowa w roztworze wygląda następująco:
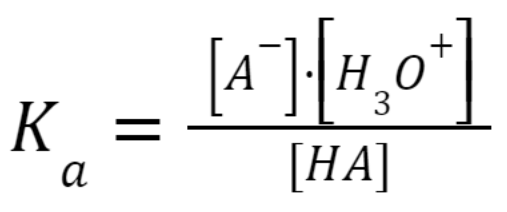
Powyższe wyrażenie można przekształcić:
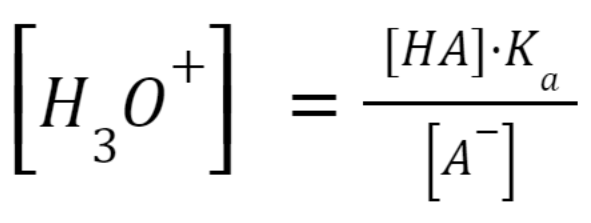
Ponieważ Ka jest wartością stałą, a [H3O+] zależy bezpośrednio od stosunku [HA]/[A–] otrzymujemy kolejne przekształcenie:
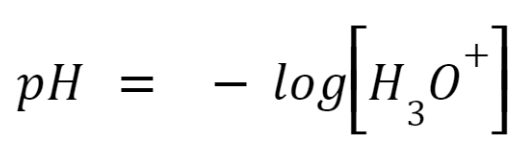
Zasadniczą funkcją buforu jest utrzymywanie pH roztworu w określonym i wąskim zakresie, a jak widać z powyższych przekształceń, stosunek [HA]/[A–] wpływa na pH buforu i tym samym na jego skuteczność. Im wyższe są stężenia A– i HA, tym mniejszy wpływ na pH roztworu będzie miało dodanie kwasu lub zasady.
Rozpatrzmy to na kolejnym przykładzie, w którym do buforu dodajemy HCl. Początkowo wytworzone protony zostaną pobrane przez sprzężoną zasadę:
A– + HCl→ HA + Cl–
Reakcja ta powoduje nieznaczną zmianę proporcji [HA]/[A–] i tym samym zmianę pH, jednak z uwagi na znaczną ilość składników buforu zmiana ta jest niewielka. Odczyn buforu będzie pozostawał w wąskim zakresie tak długo, aż obecne są w nim jony A–. Gdy limit zostanie osiągnięty, a wszystkie jony A– przereagują z kwasem, każda kolejna porcja HCl oddaje proton wodzie:
HCl + H2O → H3O+ + Cl–
Podsumowując więc cechy skutecznego bufora, możemy powiedzieć, że:
– liczby moli składników buforu (sprzężonych kwasów i zasad) muszą być znaczące w porównaniu do liczby moli kwasów i zasad, które można do buforu wprowadzić;
– najlepszą właściwość ma bufor, w którym proporcja [HA]/[A–] (na przykładzie opisywanego wyżej mechanizmu) jest równa 1 – w takim wypadku pH = pKa.

Źródło: www.pexels.com
Utrzymanie stałego pH krwi jest kluczowe dla prawidłowego funkcjonowania całego organizmu. Buforem utrzymującym odczyn krwi w wąskim zakresie (pH 7,35-7,45) jest bufor węglanowy złożony z jonów wodorowęglanowych (HCO3–) i nietrwałego kwasu węglowego (IV) (H2CO3).
Jeżeli jakikolwiek kwas dostanie się do krwiobiegu, jony wodorowęglanowe neutralizują jony hydroniowe, tworząc kwas węglowy i wodę, które są już składnikami układu buforowego krwi:
HCO3– + H3O+ → H2CO3 + H2O
Z drugiej strony, gdy to zasada dostanie się do krwiobiegu, kwas węglowy reaguje z jonami wodorotlenowymi, wytwarzając jony wodorowęglanowe i wodę:
H2CO3 + OH– → HCO3– + H2O
To już tyle, jeśli chodzi o podstawowe informacje na temat roztworów buforowych. Mamy nadzieję, że dzięki nim poradzisz sobie z tym zagadnieniem bez żadnego problemu!
W Indeksie w Kieszeni wszystkie zagadnienia tłumaczymy w zrozumiały i przystępny dla ucznia sposób. Szukasz skutecznego przygotowania do Olimpiady Chemicznej Juniorów? Jeżeli tak, to zachęcamy do zapoznania się z naszą ofertą kursów!

Strona przygotowana przez Zyskowni.pl