
Amidy są jedną z najważniejszych grup funkcyjnych w chemii organicznej, szczególnie ze względu na ich kluczową rolę w biocząsteczkach, takich jak białka. Zrozumienie ich struktury, reaktywności oraz metod syntezy jest niezbędne dla każdego, kto chciałby spróbować swoich sił w Olimpiadzie Chemicznej.
Najważniejsze informacje, których dowiesz się z tego artykułu:
Amidy to organiczne związki chemiczne będące pochodnymi kwasów karboksylowych, w których grupa hydroksylowa (–OH) została zastąpiona przez grupę aminową (–NH₂, –NHR lub –NR₂). Ich charakterystyczną cechą jest obecność grupy funkcyjnej –CONH₂, w której atom azotu bezpośrednio łączy się z atomem węgla grupy karbonylowej.
Dzięki efektowi rezonansowemu amidy są związkami wyjątkowo stabilnymi chemicznie, co odróżnia je od innych pochodnych kwasów karboksylowych, np. estrów czy chlorków kwasowych. Ta trwałość ma kluczowe znaczenie biologiczne – wiązania amidowe występują w białkach jako wiązania peptydowe, warunkując ich strukturę i właściwości.
Amidy znajdują szerokie zastosowanie nie tylko w biochemii, ale też w syntezie organicznej, farmakologii i przemyśle – są składnikami wielu leków, polimerów i materiałów o dużej wytrzymałości.
Amidy charakteryzują się specyficzną strukturą, w której atom azotu jest bezpośrednio połączony z grupą karbonylową. W większości amidów struktura ta jest płaska z powodu delokalizacji wolnej pary elektronowej atomu azotu z antywiążącym orbitalem wiązania podwójnego grupy karbonylowej (nN→π*C=O).
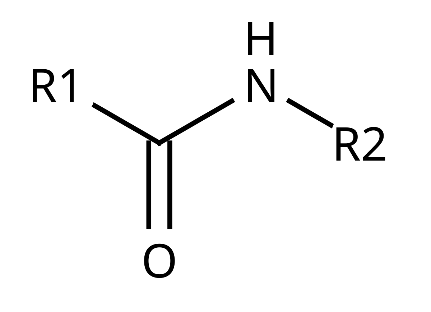
Energia rezonansu wynosząca około 15–20 kcal/mol sprawia, że wiązanie C–N ma częściowo charakter wiązania podwójnego. Taka delokalizacja zmniejsza reaktywność amidów, co wpływa na ich stabilność i trudność w przeprowadzeniu reakcji substytucji nukleofilowej.
Płaska struktura grupy amidowej jest jednym z czynników stabilizujących drugorzędową strukturę peptydów, takich jak helisy α lub harmonijki β. Dzięki płaskości sześciu atomów grupy amidowej, łańcuchy peptydowe preferują spiralne zwijanie się lub przeciwstawne położenie na planie płaskim, który to układ jest dodatkowo stabilizowany przez wiązania wodorowe.
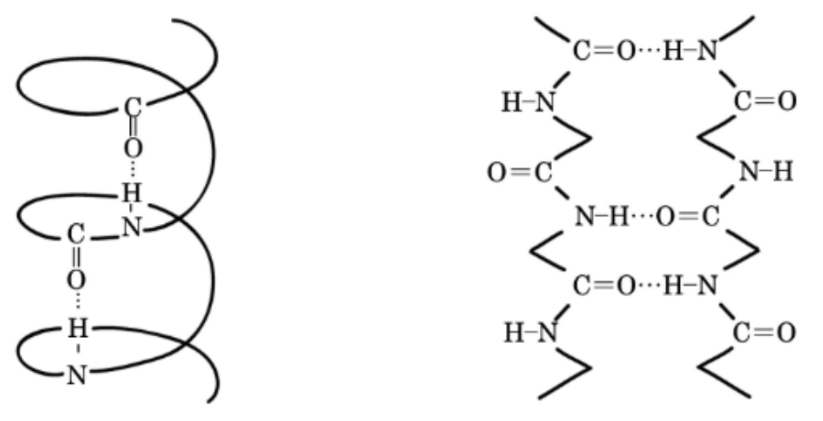
Źródło: https://yakugakulab.info/
Na tle różnych pochodnych kwasów karboksylowych takich jak chlorki, bezwodniki, estry i amidy, te ostatnie wykazują najsilniejszy efekt rezonansowy. Wynika to z niższej elektroujemności azotu w porównaniu z tlenem i chlorem, co sprawia, że azot chętniej „dzieli się” swoją wolną parą elektronową, co dodatkowo stabilizuje grupę amidową.
Z tego powodu amidy są w procesach substytucji nukleofilowej najmniej reaktywnymi pochodnymi kwasów karboksylowych. Na przykład, czas połowicznego rozpadu amidów w obojętnych roztworach wodnych sięga setek lat, w przeciwieństwie do obojętnych roztworów estrów, które rozpadają się z szybkością o kilka rzędów wyższą, co podkreśla wyjątkową stabilność chemiczną amidów.
Jest to ważne z punktu widzenia zastosowań biologicznych, w przypadku których stabilność amidów zapewnia integralność struktur białkowych. Idealnym przykładem tej trwałości jest kolagen, białko fibrylarne, którego włókno zbudowane z trzech łańcuchów polipeptydowych połączonych w potrójną helisę, jest w stanie wytrzymać ogromne obciążenia. Włókno o średnicy 1 mm jest w stanie utrzymać masę 10 kilogramów!
Podsumowując, na tle innych pochodnych kwasów karboksylowych amidy wyróżniają się najmniejszą reaktywnością. Wynika to z silnego rezonansu, który stabilizuje grupę amidową.

Źródło: www.pixabay.com
Mimo swojej stabilności, amidy mogą ulegać reakcjom addycji i substytucji nukleofilowej, jeśli rezonans w obrębie grupy amidowej jest ograniczony. Oto kilka przypadków, które mogą okazać się przydatne podczas przygotowań do Olimpiady Chemicznej.
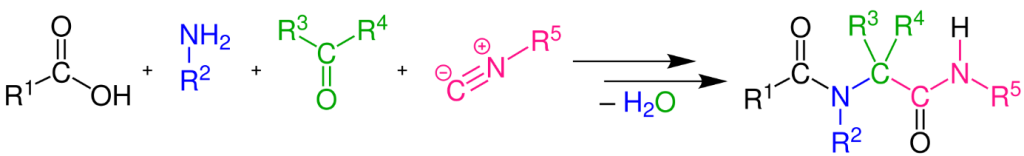
Pierwszą reakcją, jaką przedstawimy w tym punkcie, jest reakcja Ugiego, czyli wieloskładnikowa reakcja chemiczna prowadząca do powstania dwóch wiązań amidowych. Reakcja zachodzi między ketonem lub aldehydem a aminą, izonitrylem i kwasem karboksylowym, tworząc w rezultacie amid.
Nazwa reakcji pochodzi od nazwiska Ivara Ugiego, który odkrył ją w 1959 roku. Ogólne równanie chemiczne opisanej reakcji wygląda następująco:
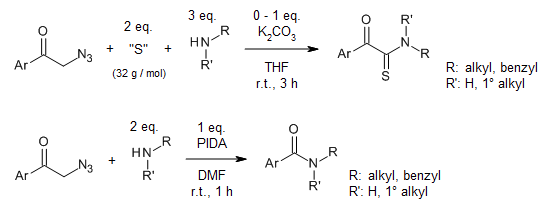
Kolejną ciekawą reakcją syntezy amidów jest bezmetalowa reakcja oksydacyjnego-amidowania, która umożliwia syntezę α-ketotioamidów i amidów z α-azydoketonów. Tionowanie wiązania C–H w α-azydoketonach z siarką elementarną może tworzyć azydek α-ketotioacylu, który jest następnie nukleofilowo atakowany przez aminy. Amidy natomiast mogą tworzyć się z uwolnieniem gazowego azotu i anionu cyjanowego w obecności PhI(OAc)2.
Protonowanie amidów może zachodzić zarówno na atomie azotu, jak i tlenu. W przypadku pierwszego z nich prowadzi do utworzenia kationu, w którym rezonans jest utrudniony ze względu na brak wolnej pary elektronowej na azocie.
W przypadku protonowania na atomie tlenu, struktura zachowuje pewien charakter rezonansowy, co zapewnia większą stabilność. Wyjątkowym przypadkiem jest protonowanie 1-azaadamantan-2-onu, który w odróżnieniu od większości amidów ulega preferencyjnemu protonowaniu na atomie azotu. Wynika to z jego unikalnej struktury przestrzennej, która zostanie przedstawiona w jednym z kolejnych akapitów, dotyczącym syntezy tego związku.
Dzięki temu amidy mogą wykazywać różne właściwości w zależności od miejsca protonacji:
W praktyce oznacza to, że warunki reakcji (np. rodzaj kwasu, rozpuszczalnika, temperatura) decydują o tym, w którym miejscu zachodzi protonacja. To zagadnienie jest istotne m.in. w biochemii, gdzie protonowanie amidów wpływa na właściwości białek i mechanizmy enzymatyczne.
W ostatnich latach opracowano wiele nowych metod tworzenia wiązań amidowych, które wykazują większą tolerancję na różnorodne grupy funkcyjne. Klasyczne metody syntezy amidów polegają na reakcji amin z aktywowanymi kwasami karboksylowymi. Istnieją także niekonwencjonalne metody, które pozwalają na tworzenie amidów w łagodniejszych warunkach oraz z większą selektywnością.
Synteza 1-azaadamantan-2-onu, o którym była mowa w poprzednim punkcie, jest bardzo ciekawym procesem. Sam w sobie związek jest również niezwykły. Jak widać na poniższym zdjęciu, jego struktura wykazuje wybitny poziom skomplikowania, jak również posiada duże naprężenia ze względu na swoją budowę.
Syntezy tego niezwykłego związku dokonali w 2016 roku Komarov oraz Kirby. Badacze ci uzyskali 1-azaadamantan-2-on metodą polegającą na termicznym amidowaniu aminokwasu zabezpieczonego N-Boc.
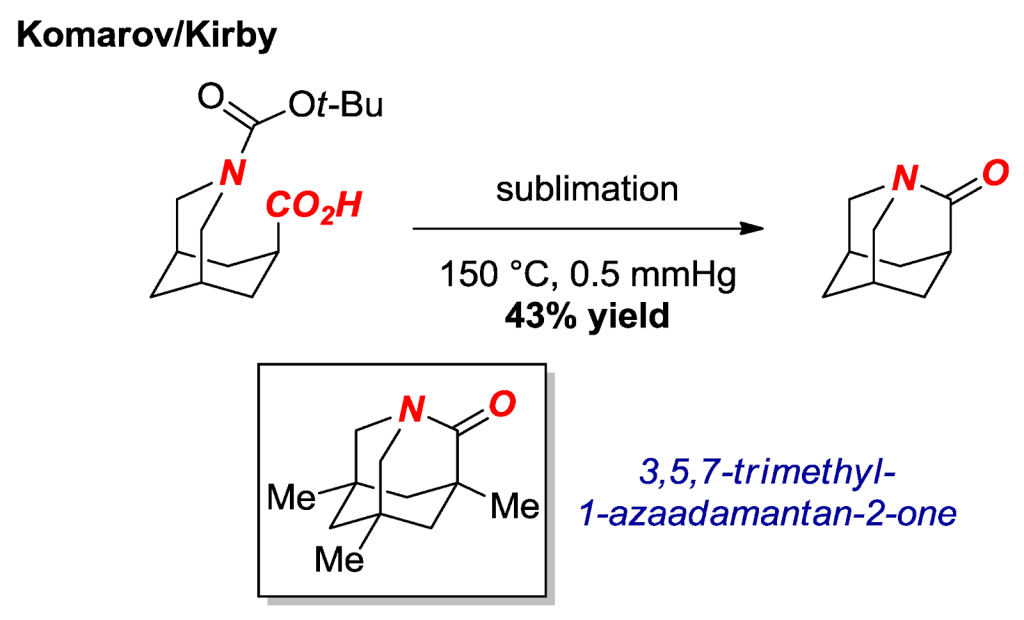
Po serii badań stwierdzono, że 1-aza-2-adamantanon (produkt reakcji, po prawej od strzałki) jest bardziej reaktywny w reakcjach z nukleofilami niż poprzedni „najbardziej skręcony amid” 3,5,7-trimetylo-1-azaadamantan-2-on (związek pod równaniem reakcji).
Podczas przygotowań do Olimpiady Chemicznej, warto zapoznać się z przykładami zadań, które obejmują:
Jesteś ciekawy też innych zagadnień z chemii organicznej? Sprawdź, skąd się biorą kolory w fajerwerkach!
Podsumowując, zrozumienie struktury, stabilności oraz metod syntezy amidów jest kluczowe, by osiągnąć sukces na Olimpiadzie Chemicznej. Przedstawione powyżej zagadnienia stanowią podstawę jeśli chodzi o reakcje chemiczne oraz komplet wiedzy dotyczącej biochemicznych właściwości amidów, potrzebnej na Olimpiadzie.
Zastanawiasz się, jak przygotować się do Olimpiady? Odpowiedź jest prosta: z kursami Indeksu w Kieszeni!
Amid to organiczny związek chemiczny zawierający grupę funkcyjną –CONH₂, będący pochodną kwasu karboksylowego.
Amidy to związki powstające w wyniku połączenia grupy karbonylowej (C=O) z atomem azotu. Odgrywają kluczową rolę w chemii organicznej i biologii.
Nazwy amidów tworzy się od nazw kwasów, od których pochodzą (np. etanamid od kwasu etanowego). Często używa się też nazw zwyczajowych, np. acetamid.
Klasycznie otrzymuje się je z amin i aktywowanych pochodnych kwasów. Istnieją też nowoczesne metody, jak reakcja Ugiego.

Strona przygotowana przez Zyskowni.pl