

Źródło: www.freepik.com
Poniższy tekst stanowi drobny wycinek kompleksowego kursu prowadzonego przez zwycięzców i laureatów najwyższych miejsc poprzednich edycji Olimpiady Chemicznej. Dzięki nauce z byłymi Olimpijczykami awans do finału Olchema jest w zasięgu ręki! Zachęcamy do zajrzenia na podlinkowaną stronę i poznania szczegółów.
Dla każdego jest zapewne oczywiste, że woda krzepnie w temperaturze 0°C zamieniając się w lód, a wrze w 100°C przechodząc w parę wodną. Należy sobie zadać jednak pytanie: czy jest tak zawsze? Być może wartości te są ściśle przypisane warunkom, w jakich znajduje się woda?
Zanim przejdziemy do sformułowania odpowiedzi, w oparciu o prawa fizyki rozważmy kilka przykładów. Pierwszym z nich jest problem, o którym można usłyszeć oglądając filmy o wysokogórskich wyprawach lub czytając relacje himalaistów. Jak się okazuje, na ekstremalnie dużych wysokościach zaparzenie herbaty stanowi czynność praktycznie niewykonalną. Zazwyczaj aby zaparzyć herbatę, potrzebujemy wody o temperaturze ok. 100°C, czyli takiej, którą dostajemy po zagotowaniu jej w czajniku. Jednak jeśli umieścimy czajnik na szczycie Mount Everest, w momencie, gdy woda się zagotuje, jej temperatura będzie równa jedynie 68°C!
Z czego wynika aż tak duża różnica? Przecież i u nas, i tam, woda przechodzi w parę wodną. Odpowiedź brzmi następująco: temperatura wrzenia (w naszym przykładzie wody, ale dotyczy to każdej substancji) zależy od ciśnienia, pod wpływem którego substancja się znajduje. Aby to sprawdzić, warto wykonać proste doświadczenie: zagotujcie wodę w czajniku i odczekajcie kilka minut, aby przestała wrzeć. Później weźcie strzykawkę (bez igły), nabierzcie odrobinę gorącej wody i po zatkaniu otworu pociągnijcie za tłok. Jaki będzie efekt? Otóż woda w strzykawce zacznie się gwałtownie gotować. Oto właśnie dowód na zależność temperatury wrzenia od ciśnienia.
Okazuje się, że podobna właściwość występuje zarówno dla wszystkich przejść fazowych, czyli zmian stanów skupienia (ciekły – stały, ciekły-gazowy i stały – gazowy), jak i względem przejść pomiędzy różnymi rodzajami faz w obrębie jednego stanu skupienia. Zależności te można przedstawić na schemacie zwanym wykresem fazowym. Spróbujmy zrozumieć, jak taki wykres interpretować.

Najpierw zajmijmy się omawianą już zależnością temperatury wrzenia od ciśnienia. Na wykresach fazowych temperatura została podana w Kelwinach – w tej skali 0°C to 273,15 K a 100°C to 373,15 K. Linia opisująca punkt wrzenia wody przebiega od punktu D do punktu E. Jak widać, dla dobrze nam znanej wartości 100°C, czyli ok. 373 K, punkt na linii odpowiada 1 atm., czyli średniemu ciśnieniu na poziomie morza. Zauważmy jednak, że gdy ciśnienie zacznie spadać, to do osiągnięcia zmiany stanu skupienia z ciekłego na gazowy potrzebna jest niższa temperatura.
Spoglądając z innej perspektywy, gdy ciśnienie jest wyższe, to potrzebujemy dużo wyższej temperatury, aby zagotować wodę. Ma to swoje odzwierciedlenie w przyrodzie. Na dnie głębi oceanicznych, w okolicy podwodnych wulkanów, temperatura znacznie przekracza 100°C, a woda ciągle pozostaje w stanie ciekłym.
Ciekawą zależnością jest ta opisana krzywą B, opisującą granicę lód (solid) – woda (lituj). Dla ciśnienia 1 atm. temperatura topnienia wynosi tyle, ile moglibyśmy przewidywać, czyli 0°C. Zobaczmy jednak, co się będzie działo, kiedy będziemy zwiększać ciśnienie. W zmieniających się warunkach lód zaczyna się topić w niższej temperaturze! Oznacza to, że w temperaturze 0°C, przy zwiększonym nacisku, woda będzie całkowicie w postaci ciekłej. Mamy więc odpowiedź na pytanie tytułowe! Jeśli wywrzemy odpowiedni nacisk na lód – tak, aby zgodnie z zależnością przedstawioną na wykresie fazowym w danej temperaturze się stopił – to możemy go roztopić wyłącznie chodząc po nim.
Kończąc analizę tego diagramu, warto zwrócić uwagę na punkt D. Odpowiada on pewnym szczególnym wartościom ciśnienia i temperatury, w których jednocześnie występują aż trzy fazy – lód, ciekła woda i para wodna. Miejsce takie nazywamy punktem potrójnym. Innym ciekawym punktem jest ten oznaczony jako E, w którym kończy się badana przez nas krzywa punktu wrzenia wody. Jest to tzw. punkt krytyczny. Powyżej tego punktu nie jesteśmy już w stanie jasno określić, w jakim stanie skupienia znajduje się woda. Stan ten nazywamy nadkrytycznym.

Analizowanie każdego z nich i porównywanie diagramów różnych substancji może dostarczyć ważnych informacji, a przy tym okazać się ciekawym doświadczeniem. Spróbujmy porównać krzywą B na diagramach fazowych wody i dwutlenku węgla. Z analizy diagramu wody wiemy, że przy zwiększaniu ciśnienia możemy stopić lód. Okazuje się, że wodę pod tym względem cechuje pewna niezwykłość! W przypadku większości substancji krzywa ta jest nachylona tak, jak na diagramie fazowym dwutlenku węgla, i zwiększanie ciśnienia powoduje, że do stopienia danej substancji potrzeba wyższej temperatury.
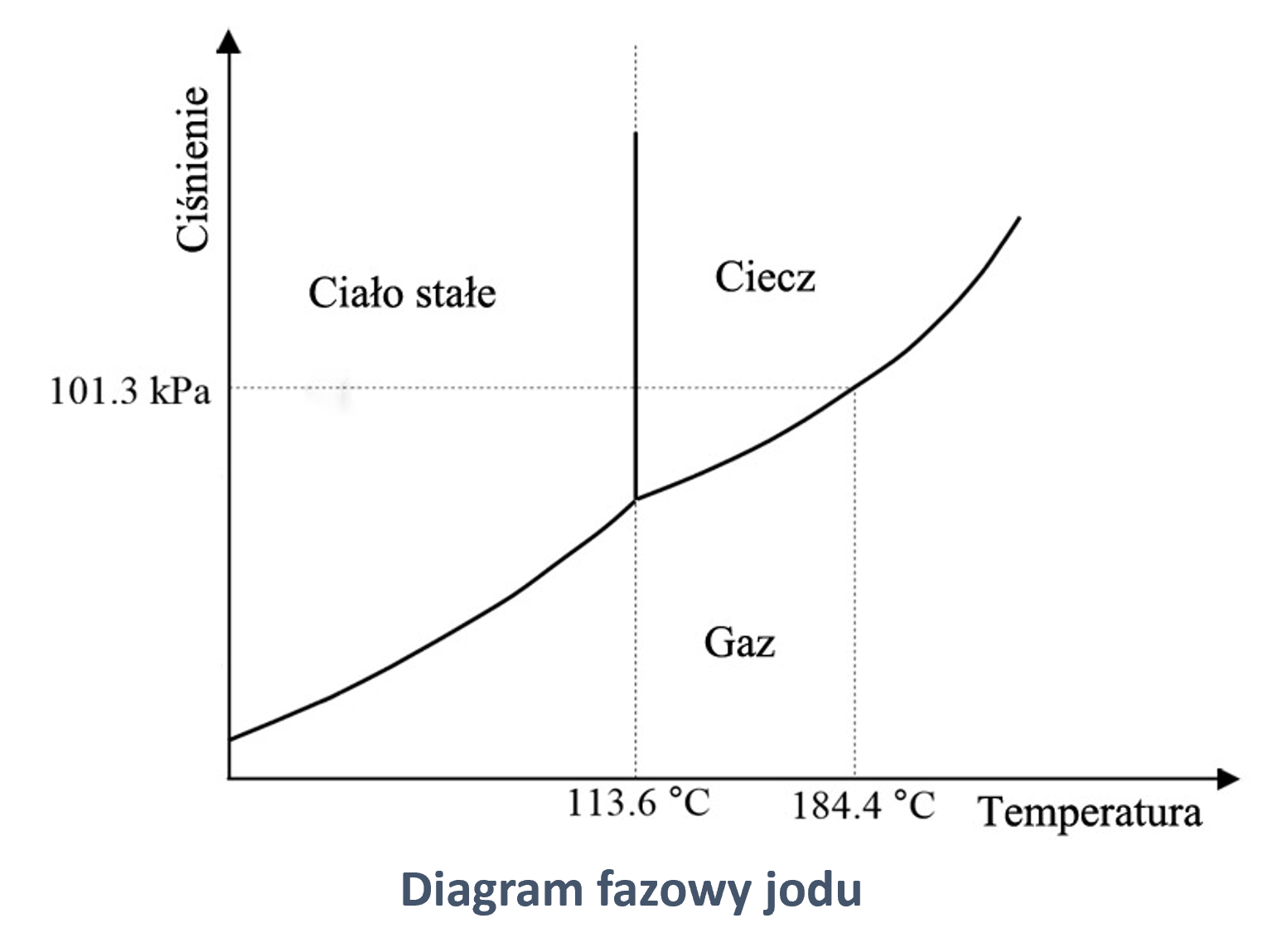
Poniżej umieszczony został również diagram fazowy dla jodu. Przeanalizujcie go i na jego podstawie spróbujcie się zastanowić, dlaczego w warunkach laboratoryjnych kryształki jodu pod wpływem temperatury od razu przechodzą w gazowy jod, a nie topnieją do stanu ciekłego.
To już koniec tego artykułu. Jeśli interesujesz się zagadnieniami chemicznymi i chcesz rozpocząć skuteczne przygotowania, dzięki którym dużo łatwiej dostaniesz się do finału Olimpiady Chemicznej, koniecznie odwiedź stronę poświęconą przygotowaniom pod okiem laureatów poprzednich edycji!
Autor tekstu: Stanisław Świerczewski
Chcesz być ze wszystkim na bieżąco? Dołącz do grupy na Facebooku!

Strona przygotowana przez Zyskowni.pl