
To bardzo ważne, aby najczęściej pojawiające się zagadnienia na maturze z chemii były dla Was ,,pewniakami”. W niniejszym artykule przypomnimy sobie podstawowe zagadnienia dotyczące prawa rozcieńczeń Ostwalda.
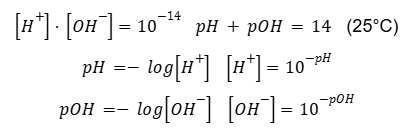
Mocne kwasy, takie jak HCl, HNO3 czy H2SO4, oraz mocne zasady typu NaOH, KOH, CsOH, Ba(OH)2 dysocjują w wodzie całkowicie. Oznacza to, że stężenie dysocjujących jonów jest stechiometrycznie skorelowane ze stężeniem cząsteczek przed ich dysocjacją przy założeniu stuprocentowej wydajności tej reakcji.
Przykładowo, jeden mol kwasu solnego w wodzie będzie odpowiadać jednemu molowi kationów H+ i jednemu molowi anionów Cl–. Dwa mole wodorotlenku baru w wodzie dysocjują na dwa mole jonów Ba2+ i cztery mole anionów OH–. Rozważenie to jest stosunkowo proste, umożliwia powiązanie stężenia mocnego kwasu lub mocnej zasady z pH i pOH. Przykładowo, roztwór HNO3 o stężeniu 0,50 mol · dm-3 wykazuje pH około 0,30, roztwór Sr(OH)2 o pH = 12,45 odpowiada stężeniu 0,014 mol · dm-3 .
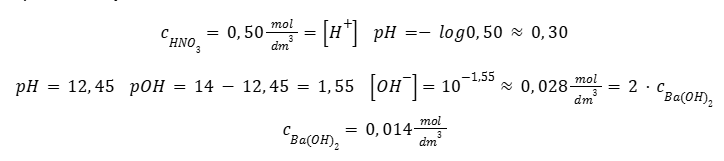
Miarą mocy kwasów i zasad jest ich wartość stałej dysocjacji kwasowej Ka i stałej dysocjacji zasadowej Kb (25°C). Wartości te są zebrane dla podstawowych nieorganicznych i organicznych kwasów i zasad w Wybranych wzorach i stałych fizykochemicznych, na stronie 9. Zdarza się, że autorzy zadań zakładają korzystanie przez Was z tych wartości w celu rozwiązania zadania obliczeniowego. Poniżej przedstawiono obowiązujące postaci rozważanych stałych dla jednoprotonowego kwasu HX i jednoprotonowej zasady B.
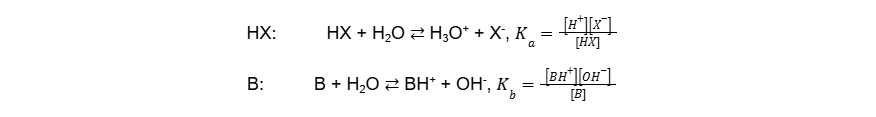
Im wyższa wartość Ka tym mocniejszy jest dany kwas, podobnie im wyższa wartość Kb, tym mocniejsza jest dana zasada. Wspomniane mocne kwasy i zasady cechują się wysokimi wartościami Ka i Kb, rzędu 102 lub wyższymi. Wszelkie pozostałe kwasy i zasady należy traktować jako słabe. Wydajność ich dysocjacji nie jest stuprocentowa. Nie można wprost stosować omawianych relacji wiążących stężenie kwasu i zasady z pH roztworu.

Źródło: www.pexels.com
Do słabych kwasów należą w szczególności wszystkie kwasy organiczne, fenole, oraz takie kwasy nieorganiczne jak wodne roztwory HCN, H2S, H2SO3, HNO2, czy nietrwały H2CO3, który powinniśmy de facto zapisać jako H2O + CO2. Do słabych zasad należy zwłaszcza wodny roztwór amoniaku i jego pochodne organiczne, czyli aminy. Należy też zwrócić uwagę, że aniony pochodzące od słabych kwasów, np. CO32-, są słabymi zasadami i odwrotnie, kationy pochodzące od słabych zasad, np. CH3NH3+, są słabymi kwasami. Ich zachowanie opisują ich stałe dysocjacji. Odpowiednio zasadowej i kwasowej, zależne od stałych dysocjacji kwasowej i zasadowej związków, które są do nich sprzężone w teorii Brønsteda, zgodnie z poniższymi równaniami.
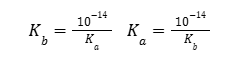
Dla słabych kwasów i zasad wprowadzono wielkość stopnia dysocjacji α, która opisuje wydajność tej reakcji. Odnosi się ją do molowego stężenia wyjściowego związku przed dysocjacją, które często opisuje się w tym przypadku wyjątkowo jako c0, stężenie początkowe. Wartość dla mocnych kwasów i zasad wynosi 100%. Zaś dla kwasów i zasad słabych jest niższa i zależy od stężenia roztworu. W przeciwieństwie do stałej dysocjacji, stopień dysocjacji nie jest więc wielkością stałą.
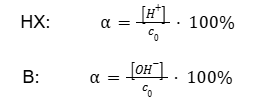
Prawem rozcieńczeń określa się ogólnie powiązanie stałej dysocjacji, kwasowej lub zasadowej, słabego kwasu lub słabej zasady ze stężeniem kwasu. Poprzez przekształcenia łatwo udowodnić, że poniższe równania są prawdziwe.
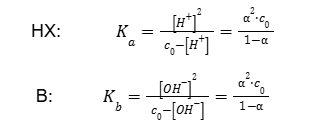
Równania po lewej stronie umożliwiają powiązanie pH roztworu z jego stężeniem i odwrotnie. W tym przypadku konieczna jest jednak znajomość odpowiedniej stałej dysocjacji. Zauważmy, że w przypadku chęci obliczenia pH na podstawie stężenia roztworu, np. kwasu octowego (Ka = 1,75 · 10-5) o stężeniu 5,00 · 10-4 mol · dm-3 konieczne jest rozwiązanie trójmianu kwadratowego przez tzw. „równanie z deltą”. Schemat rozwiązywania trójmianu jest także ukazany w Wybranych wzorach…, na stronie 13. Tylko jeden z dwóch pierwiastków rozwiązania może mieć sens fizyczny, drugi z nich zawsze będzie ujemny.
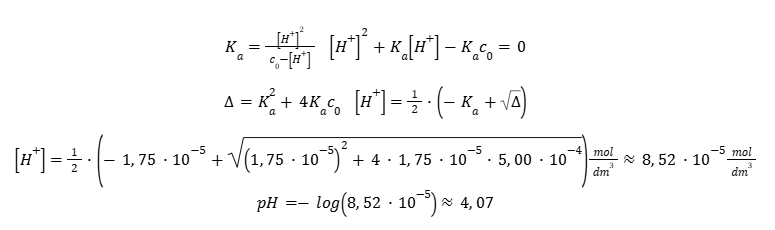
Takie podejście jest dosyć żmudne i niekiedy można je obejść, gdy spełnione są tzw. warunki uproszczenia. To umożliwi otrzymanie równania prostszego do rozwiązania, które nie będzie przebiegało przez trójmian kwadratowy.
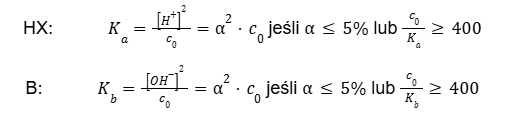
W rozważanym przypadku z kwasem octowym warunki uproszczenia nie były spełnione (sprawdź!). Natomiast w przypadku użycia kwasu octowego (Ka = 1,75 · 10-5) o wyższym stężeniu, 5,00 mol · dm-3 warunki uproszczenia są spełnione (sprawdź). A odnalezienie pH tego roztworu jest znacznie łatwiejsze.
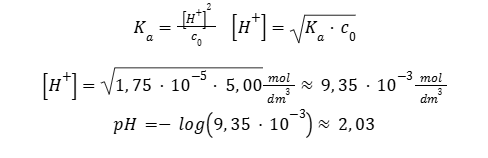
Równanie Ostwalda dosyć często pojawia się na maturze w ostatnich latach. Choć nie jest to zagadnienie występujące co roku. Warto zapoznać się z tym, jakie zagadnienia na egzaminie z chemii pojawiają się najczęściej, żebyś mógł kompleksowo podejść do przygotowania do matury!

Strona przygotowana przez Zyskowni.pl