
Czym tak właściwie jest rozpuszczalność? Pomińmy na chwilę wszystkie obowiązujące definicje i skupmy się na najprostszym przykładzie z życia, a konkretniej… z kuchni. Każdy z nas wie, że nawet nasze ulubione danie, lecz nieodpowiednio przyprawione traci swoje walory smakowe. Najprostszą przyprawą znaną od wieków jest sól kuchenna (która również jest substancją chemiczną – chlorkiem sodu). Szczególnie użyteczna jest podczas gotowania różnych typów makaronu, ryżu itp. Ustaliliśmy więc, że trzeba ją wsypać do wody. Ale czy może ona się nam roztwarzać bez końca? Otóż nie! Jej ROZPUSZCZALNOŚĆ jest ograniczona, jak w zasadzie każdej substancji. Jedne roztwarzają się w mniejszym, jedne w większym stopniu. Skąd wiemy, które należą do której kategorii? W tym właśnie pomaga nam wartość rozpuszczalności. O tym i o wielu innych zagadnieniach niezbędnych do Olimpiady Chemicznej dowiesz się na kursach Indeksu w Kieszeni!
Ilość substancji tworzącej roztwór nasycony w określonej ilości rozpuszczalnika w określonej temperaturze i ciśnieniu. Możemy przyjmować jej wartość masową – w g substancji na 100 g rozpuszczalnika, lub molową – mol/dm^3. Ale czym tak właściwie jest roztwór nasycony? Jest to roztwór, w którym nie możemy już rozpuścić więcej substancji. Dlatego wartość rozpuszczalności mówi nam o jej maksymalnej ilości zdolnej do rozpuszczenia w danej objętości/masie roztworu. Istnieją jeszcze dwa rodzaje roztworów – nienasycony i przesycony. W roztworze nienasyconym możemy jeszcze rozpuścić naszą substancję, natomiast w przesyconym – widoczne są już nierozpuszczone grudki kryształów.

Źródło: www.unsplash.com
W kontekście naszych rozważań na temat rozpuszczalności skupimy się głównie na substancjach słabo rozpuszczalnych, czyli chętniej tworzących osady. Substancje te są o tyle interesujące, gdyż często wykorzystuje się je w przypadku analizy strąceniowej. Zresztą nasze obliczenia chcemy wykorzystywać w praktyce – po co nam liczyć coś, co w zasadzie jest praktycznie nie do przekroczenia? Interesować nas będzie głównie rozpuszczalność molowa, jednakże należy pamiętać o odpowiednich jednostkach. Na olimpiadzie zazwyczaj proszą nas o podanie wartości w mol/dm^3, jednakże trzeba być ostrożnym, bo czasem zdarzają się zadania, gdzie należy podać ją w g/100 g lub w jeszcze innej jednostce. Wniosek jest jeden – trzeba być czujnym!
Dywagując na temat rozpuszczalności molowej należy poruszyć jeszcze jedną definicję – Iloczynu Rozpuszczalności.
Czym on właściwie jest? Jest to nic innego jak stała równowagi reakcji naszego rozpuszczania. Jako przykład weźmy reakcję rozpuszczania chlorku srebra.
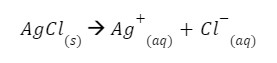
Zgodnie z definicją stałej równowagi – stosunek iloczynu stężeń produktów do iloczynu stężeń substratów – stała równowagi naszej reakcji powinna wyglądać tak:

Jednak zauważmy, że w mianowniku mamy substancję stałą, której stężenie jest… stałe! Dlatego możemy je pominąć. W związku z tym otrzymamy nasz iloczyn rozpuszczalności.
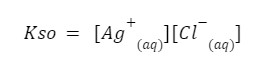
Jest to iloczyn stężeń jonów powstałych w wyniku rozpuszczania naszej soli. Należy pamiętać, aby stężenia te podnosić do odpowiednich potęg. W przypadku rozpuszczania np. fosforanu (V) wapnia:
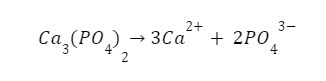
Zatem nasz iloczyn rozpuszczalności będzie wyglądać:
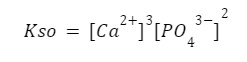
Chciałbym więc umieścić tu pewną wskazówkę, w sumie chyba najcenniejszą ze wszystkich w kontekście Olimpiady – należy zachować czujność i sprawdzać wszystko wiele razy. W zadaniach dotyczących iloczynu rozpuszczalności, zawsze należy go zapisać. Ba, czasem należy zapisać ich wiele (przykładem I etap zadanie 1 Olimpiady 66), za co komitet hojnie jak na poziom zadania obdarowuje uczestników punktami. Szkoda tracić punktów na niuansach, takich jak nieodpowiednia potęga (która może doprowadzić do utraty nawet połowy punktów za zadanie!) lub brak jednostki, za który ucinana jest połowa punktów.
Skoro znamy już podstawy teoretyczne, zajmijmy się obliczeniami, a konkretniej typowym zadaniem pojawiającym się na Olimpiadzie:
Oblicz rozpuszczalność molową soli X, jeśli jej iloczyn rozpuszczalności wynosi Y – warto umieć rozwiązywać tego typu zadania, gdyż pojawiają się na Olimpiadzie czasem nawet niezależnie od folderu wstępnego (np. zadanie 2 podpunkt g Olimpiada 60).
Skupmy się więc na konkretnym przykładzie:
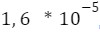
Naszą rozpuszczalność molową oznaczamy zazwyczaj jako S. Rozwiązanie zadania składa się z kilku schematycznych kroków:
1. Zapisujemy równanie reakcji:

Teraz należy podjąć analizę – ile moli jonów ołowiu powstanie nam przy rozpuszczeniu 1 mola naszej soli? Zgodnie z równaniem reakcji, gdzie nasze współczynniki przed solą i jonami ołowiu są takie same (równe 1, wtedy ich nie zapisujemy), oznacza to, że powstanie nam wtedy 1 mol jonów ołowiu.
Ile powstanie nam moli jonów chlorkowych? Zgodnie z równaniem reakcji stosunek rozpuszczanej soli do jonów chlorkowych wynosi 1:2, co oznacza, że powstaną nam 2 mole jonów chlorkowych.
Skąd to się wszystko bierze? Z równania reakcji! Należy jedynie patrzeć na odpowiednie współczynniki.
Chcemy natomiast obliczyć rozpuszczalność molową, czyli S. Zgodnie z równaniem reakcji z S moli soli powstanie nam S moli jonów ołowiowych i 2S moli jonów chlorkowych.
2. Zapisanie iloczynu rozpuszczalności
W tym przypadku będzie on wyglądać tak:

3. Podstawienie wartości S do naszego równania
Skoro już wcześniej oznaczyliśmy, że nasze stężenie jonów ołowiu = S, a stężenie jonów chlorkowych = 2S to podstawiamy je do odpowiednich miejsc w iloczynie rozpuszczalności.
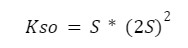
I teraz przechodzimy do bardzo ważnej kwestii – pamiętajcie o tym, że cały nawias podnosimy do odpowiedniej potęgi, nie tylko S!
Dlatego człon naszego równania:
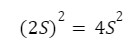
Przez co nasze równanie będzie wyglądać tak:
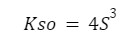
Co otrzymujemy? Tylko jedną niewiadomą! Oznacza to, że równanie da się rozwiązać, pamiętajmy, że Kso jest nam daną wartością. Przekształcamy zatem nasze równanie w celu wyliczenia S.
4. Przekształcenie równania i obliczenie wyniku
Najpierw dzielimy przez 4:
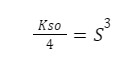
A później pierwiastkujemy pierwiastkiem stopnia 3 – dlatego bardzo ważne, jest to, aby na Olimpiadzie posiadać kalkulator naukowy, niektóre rozwiązania wymagają zastosowania pierwiastków 5 stopnia, a raczej nikt nie potrafi ich obliczyć w pamięci. 😉
Ostateczna postać naszego równania po podstawieniu wartości Kso:
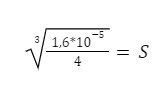
I z tego równania otrzymujemy nasz wynik:
S = 0,0159 mol/dm3 – pamiętajcie o jednostce!
Tym schematem rozwiązujemy zadania związane z obliczeniem rozpuszczalności, a więc warto nauczyć się go ze zrozumieniem, ma on tylko cztery punkty.
Nasza obliczona wcześniej rozpuszczalność jest prawdziwa w przypadku, gdy w roztworze nie zachodzą inne procesy. Jak jednak wiadomo, w nawet naszej zlewce, gdzie obecna jest tylko woda, zachodzą stałe przemiany np. autodysocjacja wody. Dlatego jak można się spodziewać, nasza obliczona wartość nie do końca będzie zgodna z prawdziwą. Jakie procesy mają na nią wpływ? Są to:
– hydroliza
– kompleksowanie
– obecność innych jonów w roztworze
Należy także pamiętać, że nasz iloczyn rozpuszczalności, jak to stała jest zależny od temperatury, w przypadku soli wraz ze wzrostem temperatury rośnie rozpuszczalność, natomiast w przypadku gazów – maleje.
Zastanówmy się jeszcze jak obecność jonów w roztworze wpływa na naszą rozpuszczalność.
W przypadku czystej wody prowadzimy podobną analizę, którą przedstawiliśmy u góry, przez co nasze:
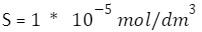
Przejdźmy zatem do naszego drugiego roztworu:
Zastanówmy się – jakie reakcje zachodzą w naszym roztworze?
Na pewno będzie to nasza reakcja rozpuszczania:
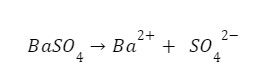
Ale nie jest to jedyna reakcja. Pamiętajmy o naszej soli w roztworze:
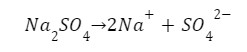
Jakie zatem będą stężenia naszych indywiduów w roztworze?
Interesuje nas stężenie jonów baru i siarczanowych (VI)

Zapisuje iloczyn rozpuszczalności nasz:
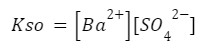
I podstawiamy nasze wartości:
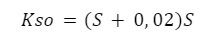
Mamy teraz dwie opcje – możemy uprościć wyrażenie lub rozwiązać równanie kwadratowe. Sprawdzimy oba wyniki:
1. Równanie kwadratowe
2.
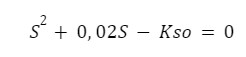
Jak rozwiązujemy? Wpisujemy do kalkulatora – znowu kalkulator naukowy oszczędza nam multum czasu!

3. Upraszczamy – skoro wiemy, że S jest znacznie mniejsze od 0,02 to nasze równanie może przyjąć postać:
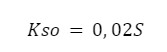
Po rozwiązaniu – S = 5*10-9 – wychodzi ten sam wynik – uproszczenie było słuszne! (nawet nieznaczna różnica pomiędzy wynikami potwierdza nam słuszność uproszczenia)
Wprowadzenie wspólnych jonów do roztworu ZMNIEJSZA rozpuszczalność soli, a sposób jak tego dowieść został przedstawiony na górze.
Uwaga! – wprowadzenie jonów wodorowych lub wodorotlenkowych, a także jonów kompleksujących ZWIĘKSZA rozpuszczalność. Dlaczego? O tym i wielu innych rzeczach możecie dowiedzieć się na naszych kursach!

Strona przygotowana przez Zyskowni.pl